![]() Capítulo 1:
Capítulo 1:
Limitaciones para el estudio de células y tejidos
![]() Capítulo 2:
Capítulo 2:
Nociones básicas de óptica
![]() Capítulo 3:
Capítulo 3:
La imagen. Sistemas ópticos
![]() Capítulo 4:
Capítulo 4:
El microscopio compuesto
![]() Capítulo 5:
Capítulo 5:
El microscopio electrónico
![]() Capítulo
6:
Capítulo
6:
Técnicas especiales de microscopía
![]() Capítulo 7:
Capítulo 7:
Nuevas tendencias
LA MICROSCOPÍA:
HERRAMIENTA PARA ESTUDIAR CÉLULAS Y TEJIDOS
CAPÍTULO
7
NUEVAS TENDENCIAS.
7.1.- Deconvolución
7.2.-Microscopios confocal
Dentro de las diversas técnicas microscópicas conocidas, la confocal es sin lugar a dudas una de las que más atractivos ofrece y se mantendrá a la vanguardia de los métodos para visualizar y estudiar el micromundo. El perfeccionamiento de los marcajes fluorescentes y la disponibilidad de sistemas de fuentes de luz cada vez más versátiles son algunas de las variables que mantendrán durante mucho tiempo al microscopio confocal como un instrumento de primera línea en la investigación biomédica.
También conocida como microscopía Raman. Es una de las técnicas de vanguardia y sin precedentes (CARS: Coherent Anti-Stokes Raman Scattering) y una de las técnicas ópticas no lineales o NLO (Non Linear Optics) que permite obtener imágenes de alta resolución en tejidos vivos o recientemente extraídos. Como una de las ventajas de esta técnica es que, al contrario de la microscopía convencional, con esta técnica no se requieren ni cortes finos o colorantes, los cuales pueden ocasionar alteraciones en las células. Por el contrario, se estudian piezas gruesas de tejidos u órganos y sin coloración alguna se obtiene imágenes 3D, incluso de los tejidos profundos.
Es una técnica fotónica de alta resolución que permite obtener en pocos segundos información sobre la temperatura, composición química y estructural de casi todo tipo de material, orgánico o inorgánico. Se realiza un análisis mediante espectroscopia que se fundamenta en el estudio de la luz dispersada por el espécimen al incidir sobre él un rayo laser, sin la necesidad de realizar ningún tipo de preparación y no produce daños sobre el tejido que se estudia, es una técnica no invasiva. Una pequeña porción de la luz que entra en un material sufre cambios de su frecuencia, es decir, cambios de color. Estos cambios son característicos de cada material, lo que facilita su identificación.
Con este
método se puede detectar las vibraciones de los enlaces químicos
de los componentes celulares, notablemente de los lípidos, como
por ejemplo los contenidos en la mielina. Se emplea una luz monocromática
(laser) y el patrón de dispersión de la luz (espectrograma)
refleja los cambios en los estados de las moléculas (146).
Fue descrito inicialmente por el físico indio Chandrasekhara Venkata Raman en el año 1928, motivo por el cual gana el premio Nobel de Física en el año 1930. Mediante un experimento sencillo demostró que el color azul del agua procedía de un fenómeno propio o de dispersión de la luz al interactuar con las moléculas de agua. Uno de sus colaboradores notó que la luz solar filtrada cambiaba de color al pasar por el agua y alcoholes, efecto que no fueron capaces de suprimir y lo atribuyeron como una característica propia de esas sustancias.
Este fenómeno se denominó radiación secundaria y se logra al hacer incidir sobre una muestra un rayo de luz de una frecuencia determinada. La luz dispersada por la muestra puede tener la misma frecuencia de la luz incidente pero esto es irrelevante; o por el contrario, la luz dispersada puede presentar una frecuencia diferente a la de la luz incidente y esta si aporta datos sobre la composición molecular de la muestra y es lo que se denomina dispersión Raman. Estas variaciones de frecuencia corresponden a variaciones de energía. Los átomos e iones de la muestra están en constante movimiento (vibración y rotación) el cual está determinado por la masa y los enlaces químicos. A cada movimiento corresponde un determinado nivel de energía molecular.
Cuando los fotones de la luz incidente tienen una energía mayor, estos chocan con las moléculas de la muestra y la mayoría de los fotones la atraviesa; pero unos pocos fotones son dispersados (uno por cada 1011). Cada fotón incidente ocasiona cambios en las moléculas, llevándolas a un nivel de energía superior y estas para recuperar rápidamente el equilibrio emiten un fotón, el cual al ser liberado, a su vez tendrá una frecuencia determinada. El fotón dispersado puede tener una frecuencia diferente a la de los fotones incidentes, la cual puede ser mayor o menor y se visualiza con un color diferente al de la luz incidente. Cada material tendrá un patrón característico de dispersión de los fotones y en ocasiones se produce un efecto de fluorescencia (146, 147).
Esta técnica permite el análisis de materiales sin la
necesidad de preparaciones especiales y no ocasiona daños a las
muestras, las cuales pueden ser sólidas, líquidas o gaseosas.
Es inocuo para las células y tejidos vivos.
Los primeros experimentos en microscopía con el método CARS se iniciaron en la década de 1980 por Duncan y colaboradores (148), pero en el año 1999 Xie y colaboradores revivieron esta técnica microscópica (149) y desde entonces numerosos avances se han logrado combinando varias técnicas, dentro de ellas la microscopía multifotónica multimodal (MMM). Se logra combinando varias técnicas para conformar un microscopio muy complejo.
Conformación
del microscopio:
Estas técnicas han abierto nuevas perspectivas en microscopía,
permitiendo principalmente la obtención de imágenes tridimensionales.
De manera simplificada, para facilitar la comprensión de la configuración
y principios de este instrumento, se puede decir que es un microscopio
de barrido que emplea rayos láser y está diseñado
con la combinación de las técnicas (figs. 7-2, 7-3):
• Fluorescencia con iluminación de dos fotones.
• Frecuencia de suma (SFG: Sum Frecuency Generation): Generación de una luz cuya frecuencia es la suma de otras dos frecuencias.
•
Óptica no lineal (NLO) basada en CARS (Coherent Anti-Stokes Raman
Scattering): Se logra con láser de alta intensidad y emitido
en pulsaciones de alta frecuencia el cual al pasar por un medio transparente
produce cambios en la frecuencia de la luz (mezcla de frecuencias, armónicos).
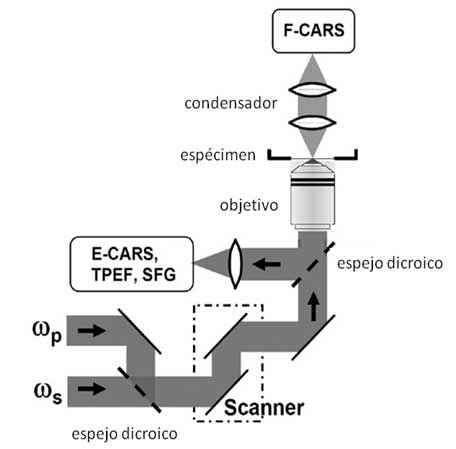
Figura 7-2.-Esquema simplificado del microscopio de barrido láser CARS que permite la formación de imágenes mediante la combinación de CARS, fluorescencia de dos fotones (TPEF) y generación de frecuencia de suma (SFG). Se emplean dos rayos láser de pulso sincronizado (wp – ws). Tomada de Cheng .J. X. Coherent anti-Stokes Raman scattering microscopy (147).
Como fuente de iluminación se emplean dos rayos láseres de zafiro, sincronizados mediante un controlador electrónico en pulsos en el orden de 5 picosegundos (150) y dispuestos de manera paralela para ser combinados en uno solo (SFG) el cual es enviado a un microscopio de barrido confocal.
Ventajas
de la microscopía CARS (146):
• Permite un contraste basado en las vibraciones moleculares que
son intrínsecas y propias de la muestra. Por lo tanto, no se
requiere coloración u otro medio de contraste fluorescente, evitando
así la toxicidad de dichas sustancias químicas y algunos
artificios de las técnicas de coloración o marcaje.
• Gracias a la óptica no lineal (NLO) y a la alta intensidad del láser, permite la obtención de cortes ópticos tridimensionales de células y es muy útil en el estudio de tejidos gruesos.
• Mediante el empleo de longitudes de onda cercanas al espectro infra-rojo, se tiene un mayor poder de penetración en la muestra de alrededor 0.3mm, permitiendo la obtención de imágenes en muestras gruesas de tejidos.
•
En condiciones de uso normal, hay absorción escasa o nula de
los dos rayos láser empleados, lo cual reduce el daño
del tejido producido por las radiaciones utilizadas.

Figura 7-3.-Diagrama esquemático de un microscopio CARS multimodal que permite detección CARS (E-CARS: epi-detección, F-CARS: (forward) detección anterior), fluorescencia de dos fotones (TPEF) y generación de frecuencia de suma (SFG). Dos rayos láseres de zafiro se sincronizan y combinan para ser enfocados en el espécimen. Las señales CARS son recogidas por un condensador y detectadas por un fotomultiplicador 1 (PMT1), otras señales (E-CARS), de fluorescencia de dos fotones (TPEF) y de frecuencia de suma (SFG) son colectadas por el objetivo y detectadas por otro fotomultiplicador 2 (PMT2). Un espectrómetro analiza señales para análisis microespectral con una resolución de un pixel mediante barrido confocal. Tomado de Wang H W, Le T, Cheng J X, (2008). Opt. Comm., 281, 1813-1822. (151).
Aplicaciones:
Este microscopio se aplica en numerosas áreas tales como la petroquímica
y notablemente en la biomedicina el estudio de proteínas, lípidos,
carbohidratos y otras moléculas en su estado fisiológico
natural y en el estudio de procesos como la respuesta inmune, enfermedades
del sistema nervioso central y desarrollo de otros tumores (146, 147,
148) (fig. 7-4).
El estudio de dominios lipídicos y la heterogeneidad en la composición de las membranas celulares es crucial para entender fenómenos de transducción de señales, tráfico de membranas y en enfermedades. El empleo de CARS para la detección de la vibración de CH2 de los lípidos de membrana ha permitido el análisis cualitativo y cuantitativo de los mismos (147, 152).
Se ha utilizado recientemente en la observación de pacientes con daños de la médula espinal y nervio ciático y en estudios de cáncer, enfermedades cardiovasculares y obesidad (figs. 7-5 y 7-6) (150, 151, 153, 154, 155, 156). Las perspectivas que se tienen con este método de obtención de imágenes son muchas, como por ejemplo el estudio de la difusión de medicamentos y su distribución en los tejidos en tiempo real (gracias a la fluorescencia de ciertos polímeros biodegradables que se emplean como vehículo para los medicamentos). Otra de las aplicaciones es en la endoscopia para diagnosticar tumores de órganos y lesiones en las arterias.
En el futuro
se plantea la aplicación de los tratamientos médicos de
manera individualizada en pacientes que no responden a los fármacos
habituales, al permitirles a los médicos un estudio detallado
de la arquitectura de las lesiones y su progreso o mejoría. Se
promete por este medio un mejor diagnóstico y un tratamiento
adecuado a cada paciente en particular.
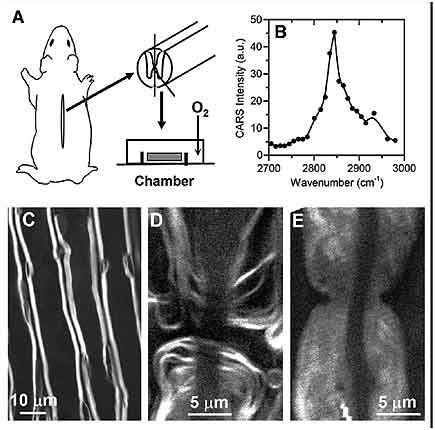
Figura 7-4.-Imágenes de la vaina de mielina obtenidas por CARS a partir de la médula espinal de un animal de experimentación (cobayo). A, Esquema que muestra el procedimiento para la obtención de la muestra de sustancia blanca de la médula espinal del cobayo. B, perfil del espectro de la mielina en CARS. C, Mielina (líneas blancas) en axones paralelos mediante F-CARS. D, imagen de un nodo de Ranvier mediante CARS. E, imagen de daño en el nodo de Ranvier, causado por lisofosfatidilcolina. Tomado de Cheng J. X. Coherent anti-Stokes Raman scattering microscopy. Appl Spectrosc. 2007; 61:197-208 (147).
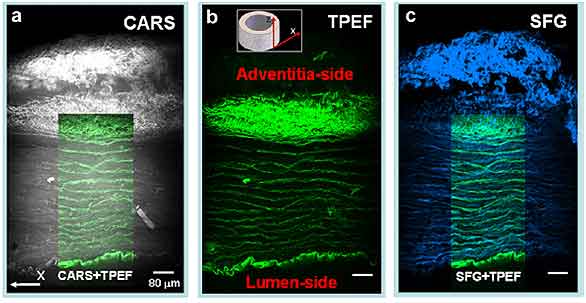
Figura 7-5.-Imágenes de cortes de pared de arteria carótida obtenidas mediante óptica no lineal (NLO) en un microscopio multimodal CARS, dos fotones (TPEF) y de frecuencia de suma (SFG) con un objetivo 20x. En a, imagen CARS en gris de la pared arterial. Se ha superpuesto la imagen de las bandas de elastina obtenida mediante la técnica de fluorescencia de dos fotones (en verde, imagen del centro). En b, en la parte superior se aprecia un modelo que muestra un corte transversal de la arteria y en verde la fluorescencia de las bandas de elastina en la pared. En c, imagen de frecuencia de suma donde el colágeno se ve de color azul y superposición de la imagen b para mostrar simultáneamente la disposición de colágeno y elastina en la capa media de la arteria. Tomado de Wang H W, Le T, Cheng J X, (2008). Label-free imaging of arterial cells and extracellular matrix using a multimodal CARS microscope, Opt. Comm., 281, 1813-1822 (151).
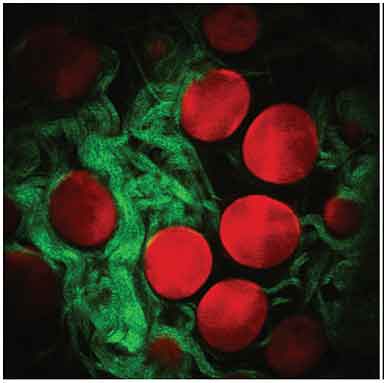
Figura 7-6.-Imagen tridimensional de adipocitos mediante la técnica de fluorescencia de dos fotones (rojo) y fibras de colágeno tipo I mediante la técnica de frecuencia de suma (SFG) (verde). Tomada de Le T., Rehrer C., W., Huff T., B., Nichols M., B., Camarillo I., G., Cheng J. X. (2007 (155).
7.4.-Microscopía de Resonancia Magnética de Fuerza
7.5.-Microscopía Virtual
7.6.-Digitalización y procesamiento de imágenes microscópicas
7.7.-Nuevas tecnologías