![]() Página Principal
Página Principal
![]() Información General
Información General
![]() Personal
Docente
Personal
Docente
![]() Docencia
Docencia
![]() Investigación
Investigación
![]() Laboratorios
de Técnicas
Laboratorios
de Técnicas
![]() Extensión
Extensión
![]() Noticias
y Eventos
Noticias
y Eventos
![]() Enlaces de Interés
Enlaces de Interés
![]() Contactos
Contactos
Técnicas Histológicas
Básicas - Inmunohistoquímica - Cursos
- Normas de Seguridad
Laboratorio de Inmunohistoquímica:
 |
Creado recientemente en las instalaciones de la cátedra, esta laboratorio está equipado para la realización de técnicas básicas de Inmunohisto-química, las cuales se desarrollan en el marco de proyectos de investigación elaborados tanto por los estudiantes de pregrado como por los profesores de la unidad académica. Se presta asesoría técnica a otras dependencias de la universidad. |
Importancia de la Inmunohistoquímica
Como técnica de laboratorio la Inmunohistoquímica es de vital importancia para el marcaje selectivo de proteínas y otros elementos que pueden estar presentes, tanto en las membranas celulares, citoplasma, y demás compartimientos citoplásmicos, así como también en la matriz extracelular.
Es de gran utilidad en la identificación de las estirpes celulares de los tejidos básicos, de receptores de membranas, proteínas citosólicas, y de cualquier otra estructura para la cual se halla desarrollado un anticuerpo específico. Su aplicación es de indiscutible valor en anatomía patológica en el diagnóstico de lesiones tumorales y su pronóstico y en la investigavión en general, sobre todo en la definición del inmunofenotipo de las células de los tejidos.
Es un proceso de numerosos pasos que requiere de un entrenamiento especializado sobre todo en el procesamiento de los tejidos, la selección de todos y cada uno de los reactivos necesarios apropiados, y lo más importante: la interpretación de los inmunomarcajes en las preparaciones histológicas.
Fundamento:
La técnica de Inmunohistoquímica se fundamenta en la reacción Antígeno - Anticuerpo.
El anticuerpo es el reactivo fundamental y la disponibilidad de antisueros, fracciones de inmunoglobulinas y anticuerpos monoclonales que permiten marcar antígenos celulares y tisulares es cada vez mayor.
Los anticuerpos pertenecen a un grupo de proteínas denominadas Inmunoglobulinas, presentes en cinco clases y sintetizadas por células conocidas como Plasmocitos, que no son mas que un último grado de diferenciación de los linfocitos B.
Loa anticuerpos monoclonales son producidos por un clon indiccidual de plasmocitos, mientras que los anticuerpos policlonales son producidos por diferentes plasmocitos y en consecuencia pueden reaccionar con varios fragmentos del antígeno para el que fueron creados. El animal más utilizado para la producción de anticuerpos policlonales es el conejo, seguido por la cabra, oveja, caballo, entre otros. Para los anticuerpos monoclonales, el animal de elección es el ratón, tal vez por motivos económicos.
La reacción antígeno - anticuerpo en la técnica inmunohistoquímica es incolora y para hacerla evidente, se utilizan algunos métodos como la fluorescencia, las reacciones enzima-sustrato que convierte al cromógenosin color en un compuesto coloreado que permite identificar el lugar donde se depositaron los anticuerpos utilizados.
Ficha técnica del inmunomarcaje indirecto con amplificación peroxidasa-dab
PROTOCOLO PARA LA TÉCNICA DE INMUNOPEROXIDASA
Para tejidos incluidos en parafina
DESPARAFINAR:
· Xilol: 2 x 5’ c/u.
HIDRATACIÓN:
· Alcohol 100%: 2 x 5’ c/u.
· Alcohol 95 %: 1 x 5’
· Alcohol 70 %: 1 x 5’
· Lavado en agua de chorro: 15’
DESENMASCARAMIENTO ANTIGÉNICO:
Tratamiento al calor en olla de presión
· Ebullición en tampón citrato: 1’30’’
· Enfriamiento a temperatura ambiente
BLOQUEO DE LA ACTIVIDAD DE PEROXIDASA ENDÓGENA:
· Baño en PBS: 2 x 5’
· Eliminar exceso de líquido del preparado
· Solución de Peróxido de Hidrógeno (KIT
LSAB): 5’
· Baño en PBS: 2 x 5’
INMUNOMARCAJE:
· Bloqueo protéico Solución Bloqueadora DAKO: 10’
· Incubación con el Anticuerpo Primario: 30’
· Baño PBS: 2 x 5’
· Incubación con Anticuerpo Biotinilado (KIT): 10’
· Baño PBS: 1 x 5’
· Incubación con Streptavidina-Peroxidasa (KIT): 10’
· Baño PBS: 1 x 5’. Preparar solución reveladora
DAB
· Revelación con DAB (KIT): 10’ aprox. (verificar
revelación)
· Baño PBS: 1 x 5’
· Baño en agua destilada. Preparación para la contracoloración.
· Contracoloración con Hematoxilina de Mayer: de 30’’
a 1-2’ (verificar coloración)
· Lavado con agua de chorro hasta obtener agua clara.
MONTAJE:
· Proceder como de rutina (deshidratación, xilol)
· Montaje en medio permanente: Martex
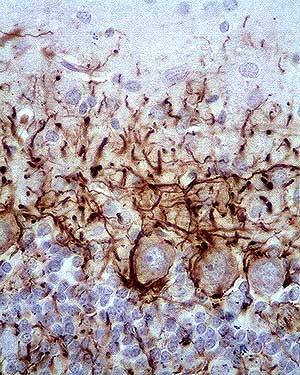 |
Inmunomarcaje: Anticuerpo Primario: Anti Neurofilamentos - Núcleos: azul |
Facultad de Medicina. Departamento de Ciencias Morfológicas - Cátedra de Histología
Av. Don Tulio Febres Cordero-Mérida-5101.Venezuela .
Telefonos: +58 274 240 31 20 - 240 31 21
Fax: +58 274 240 31 20
E-mail: histomed@ula.ve