![]() Capítulo 1:
Capítulo 1:
Limitaciones para el estudio de células y tejidos
![]() Capítulo 2:
Capítulo 2:
Nociones básicas de óptica
![]() Capítulo 3:
Capítulo 3:
La imagen. Sistemas ópticos
![]() Capítulo 4:
Capítulo 4:
El microscopio compuesto
![]() Capítulo 5:
Capítulo 5:
El microscopio electrónico
![]() Capítulo
6:
Capítulo
6:
Técnicas especiales de microscopía
LA MICROSCOPÍA:
HERRAMIENTA PARA ESTUDIAR CÉLULAS Y TEJIDOS
CAPÍTULO
6
TÉCNICAS ESPECIALES DE MICROSCOPÍA
6.1.-Microscopio de campo oscuro
6.2.-Microscopio de contraste de fase
Las investigaciones iniciales de Frits Zernike al inicio de la década de 1930 revelaron que en microscopía, al crear interferencias en la luz empleada para iluminar el espécimen se creaban condiciones que producían un incremento del contraste. Este descubrimiento le valió el premio Nobel en física en el año 1953 y revolucionó la investigación en biomedicina al permitir el estudio de células vivas. Con esta técnica de iluminación se aumenta el contraste de manera notoria entre las partes claras y oscuras de las células transparentes.
El principio es semejante al de campo oscuro; se ilumina la muestra con un cono hueco de luz pero mucho más estrecho. Se emplea un filtro en forma de anillo que disminuye la intensidad de la luz y al mismo tiempo provoca un retraso o desfase en la longitud de onda de la luz. Este método induce variaciones sutiles en el índice de refracción (determinado por el espesor) de los especímenes translúcidos permitiendo visualizar una riqueza de detalles muy finos en la estructura, los cuales pasarían desapercibidos con una iluminación de campo claro (15).
Los heterogéneos
componentes celulares absorben la luz de diferente manera y causan pequeñas
variaciones de fase en las radiaciones luminosas, es decir, las retrasan
ligeramente al disminuir la velocidad a la cual viajan y el retraso
varía según el tipo de estructura. En las células
y tejidos no coloreados, el escaso contraste se mejora y acentúa
al transformar las diferencias de fase (invisibles al ojo humano) en
diferencias de intensidad luminosa las cuales sí son detectables.
Este tipo de microscopio también se denomina de Fases o Diferencia
de Fases (98) (figs. 6-9 y 6-10).
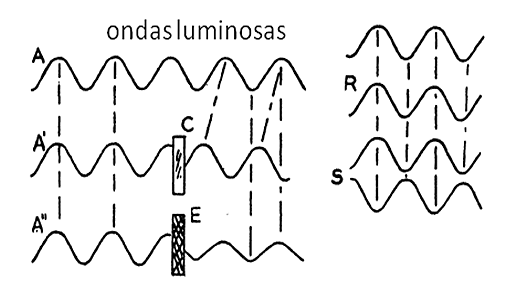
Figura 6-9.-Esquema que representa parte del principio de la iluminación en contraste de fases. A representa una onda luminosa. En A’ al atravesar el objeto transparente C, la onda se retrasa con respecto a la onda A (que no ha pasado por el objeto). En consecuencia, la onda A’ está desfasada con respecto a la onda A. El ojo humano y las placas fotográficas no son sensibles a estas diferencias de fase. La onda A’’ al pasar por un medio absorbente E reduce su amplitud (la distancia entre la cresta y el valle de la onda) y al contrario de las diferencias de fase, las diferencias de amplitud si son visibles. En R se combinan ondas de igual fase y amplitud las cuales se suman y producen aumento del brillo de la imagen. En S las ondas combinadas están desfasadas y producen incremento del contraste de las sombras y zonas oscuras de la imagen. Otras combinaciones producen el contraste de los tonos de gris. Tomado de Bennett A; Jupnik H; Osterberg H; Richards O W. Phase Microscopy (98).
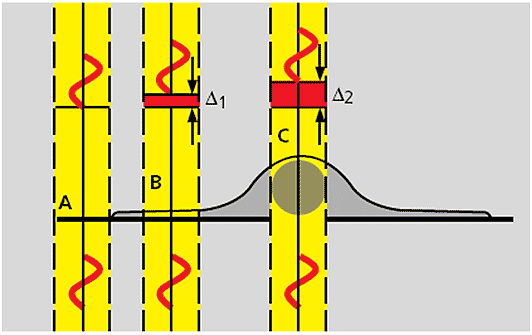
Figura 6-10.-Esquema que muestra una célula sin coloración en la cual la parte con más espesor corresponde a la zona del núcleo C, el citoplasma a la zona delgada periférica B y el portaobjeto o solución acuosa circundante A. Existen diferentes índices de refracción entre A, B y C los cuales son invisibles al ojo humano. Las ondas que atraviesan una zona más espesa se retrasan y cambian de fase en relación a las ondas que atraviesan una región más delgada. El contraste de fases hace visible esas diferencias al traducirlas en cambios de intensidad (brillo). Compárese el comportamiento de las ondas con la figura 6-9. Tomado de Kapitza H G. (1997). Microscopy from the very begining (13).
Para convertir un microscopio convencional en uno de contraste de fases se sustituye el condensador y el objetivo por los de contraste de fases, los cuales contienen un filtro en anillo y una placa de fases respectivamente (fig. 6-11). Los objetivos de contraste de fases se identifican por sus letras verdes y la indicación del tamaño del anillo de fases (Ph1, Ph2, Ph3 o PhC, PhL, PhP) (12).
El método de Zernike
consiste en acelerar las ondas en ¼ de longitud de onda y como
resultado la interferencia produce una imagen con detalles oscuros sobre
un fondo claro, denominándose contraste de fase oscuro o positivo.
Otro método consiste en el efecto contrario, es decir, retrasar
o disminuir la velocidad de la luz en ¼ de longitud de onda y
la interferencia produce una imagen con detalles brillantes en un fondo
oscuro y se denomina contraste de fase brillante o negativo (15) (figs.
6-12 y 6-13).
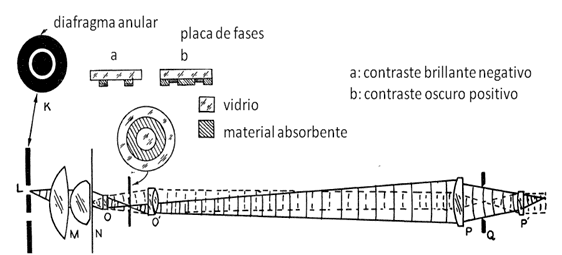
Figura 6-11.- Diagrama para el microscopio de contraste de fases. K: filtro anular, L: vista transversal del filtro anular, M: condensador, O-O’: objetivo, P – P’: ocular, Q: diafragma del ocular. La placa de fases está colocada entre las lentes del objetivo y funciona como otro filtro que crea la difracción de la luz. a y b: configuración de los filtros para producir el contraste negativo o positivo respectivamente. Modificado de Richards O W. (1954). Phase Microscopy 1950-1954 (99).
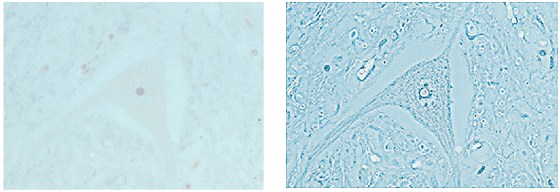
Figura 6-12.-Micrografías de una neurona en campo claro (izquierda) con detalles casi invisibles y con iluminación de contraste de fases oscuro o positivo (derecha) en el que los detalles son más evidentes en un fondo claro. Tomado de Kapitza H G. (1997). Microscopy from the very begining (13).
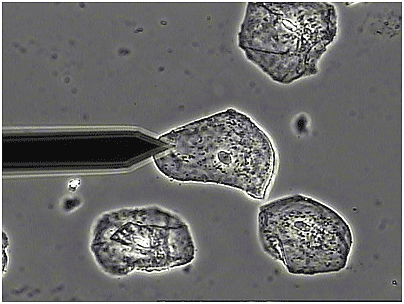
Figura 6-13.-Micrografía de células epiteliales en cultivo mediante la técnica de contraste de fases brillante o negativo, en la cual los detalles y bordes de las células aparecen brillantes (debido a un halo de difracción) en un fondo oscuro. Tomada de Asylum Reseach. Simultaneous Atomic Force and Phase Contrast Microscopy Using the MFP-3D™ AFM. (100).
6.2.1.-Aplicaciones del microscopio de contraste de fases
• Observación de células y tejidos vivos.
• En estudios de diversas disciplinas como por ejemplo fisiología, parasitología, farmacología (procesos celulares, identificación y cuantificación de microorganismos y parásitos en fluidos y tejidos, efecto de medicamentos y otras sustancias en las células y sus procesos de motilidad, ciclosis, digestión, entre otros).
• Estudio de alimentos y medicinas.
• Análisis de materiales industriales (metales, cristales, fibras sintéticas, plásticos, pigmentos, emulsiones y suspensiones minerales).
•
Estudios geológicos (minerales).
6.3.-Microscopio de luz polarizada
6.4.-Microscopio de contraste por interferencia diferencial
6.5.-Microscopio de fluorescencia
6.6.-Microscopio de luz ultravioleta
6.7.-Microscopio confocal
6.8.-Otros tipos de microscopios