![]() Capítulo 1:
Capítulo 1:
Limitaciones para el estudio de células y tejidos
![]() Capítulo 2:
Capítulo 2:
Nociones básicas de óptica
![]() Capítulo 3:
Capítulo 3:
La imagen. Sistemas ópticos
![]() Capítulo 4:
Capítulo 4:
El microscopio compuesto
![]() Capítulo 5:
Capítulo 5:
El microscopio electrónico
![]() Capítulo
6:
Capítulo
6:
Técnicas especiales de microscopía
LA MICROSCOPÍA:
HERRAMIENTA PARA ESTUDIAR CÉLULAS Y TEJIDOS
CAPÍTULO
6
TÉCNICAS ESPECIALES DE MICROSCOPÍA
6.1.-Microscopio de campo oscuro
6.2.-Microscopio de contraste de fase
6.3.-Microscopio de luz polarizada
6.4.-Microscopio de contraste por interferencia diferencial
6.5.-Microscopio de fluorescencia
6.6.-Microscopio de luz ultravioleta
6.7.-Microscopio confocal: O Microscopio láser de barrido
En la microscopía fotónica clásica el tejido debe cortarse finamente para ser examinado y mientras más delgado sea, más nítida será la imagen; pero con este método se pierde la información tridimensional durante el corte. Si una muestra gruesa es observada al microscopio fotónico, la imagen que se enfoca se ve contaminada por la superposición de los elementos del tejido que están fuera de foco, tanto por encima como por debajo del plano enfocado; la imagen enfocada se deteriora a causa de las estructuras superpuestas borrosas o no enfocadas.
Con el microscopio confocal estas limitaciones han sido superadas, ya que es un instrumento que permite realizar cortes ópticos finos a muestras de tejidos más o menos gruesos y realizar reconstrucciones en tres dimensiones a partir de cortes seriados. Fue inventado en el año 1955 por el científico estadounidense Marvin Minsky (116) al estudiar neuronas. Su mecanismo, basado en el microscopio de fluorescencia hace posible la obtención de imágenes de la arquitectura tridimensional de células y tejidos.
Los detalles
de la óptica del microscopio confocal son complejos y complementado
por métodos electrónicos y de computación, este
instrumento permite enfocar únicamente un plano determinado del
espécimen, eliminando la luz (fluorescencia) procedente de las
regiones que no están en el plano de enfoque (fig. 6-25).
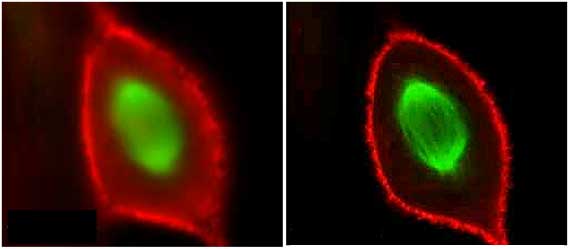
Figura 6-25.- Comparación entre dos micrografías de una célula en mitosis, contrastada con un doble marcaje fluorescente, tanto para los cromosomas (verde) y la actina (rojo). A la izquierda se aprecia una imagen donde la profundidad de campo abarca prácticamente todo el espesor de la célula y en consecuencia la imagen se ve un tanto borrosa a pesar de estar enfocada. A la derecha se observa una imagen obtenida con el principio confocal, que consiste en un corte óptico de la célula donde se captura la fluorescencia que proviene exclusivamente de las estructuras que están en el plano de enfoque, obteniéndose una imagen más nítida. Tomado de Laser Scanning Confocal Microscopy. The Imaging Technology Group (117).
Este microscopio tiene mucho éxito en el mundo científico gracias a la alta calidad de las imágenes que proporciona a partir de especímenes preparados con las técnicas de laboratorio habituales para la microscopía de fluorescencia y por supuesto, al creciente número de aplicaciones.
6.7.1.-Ventajas del microscopio confocal
• Uso de la fluorescencia (epi-fluorescencia).
• Enfoca un solo plano del espécimen.
• Elimina la información proveniente de otros planos no enfocados del espécimen.
• Obtención de cortes ópticos seriados a partir de muestras con cierto grosor o cuyo corte fino se dificulta.
•
Gracias a programas de computación, se combinan los cortes ópticos
seriados y a partir de ellos se reconstruye en tres dimensiones la estructura
observada.
6.7.2.-Principio de la microscopía confocal
El microscopio confocal añade el principio de iluminar el espécimen punto por punto y elimina la luz proveniente de los planos no enfocados. Para ello se necesita una fuente de luz muy potente, así como también un filtro con un agujero que se coloca en el trayecto del rayo de luz (118) (figs. 6-26, 6-27). Minsky lo logró con una lámpara de arco de zirconio, pero en los microscopios modernos se emplea un rayo laser, cuya longitud de onda puede estar disponible en un amplio rango de frecuencias.
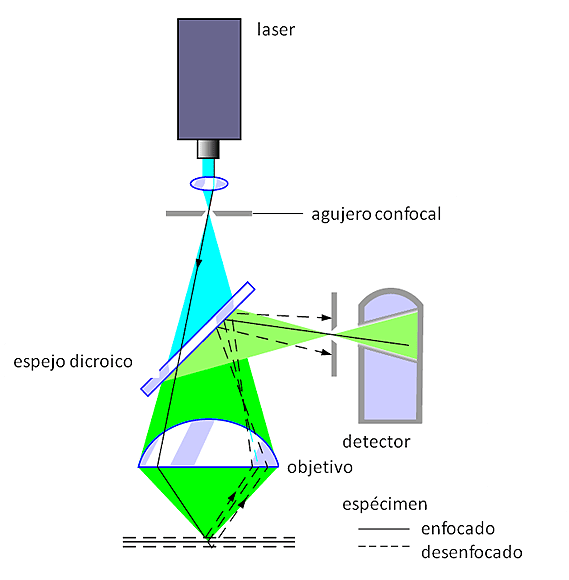
Figura 6-26.-Esquema que muestra de manera simplificada el principio del microscopio confocal y el trayecto de la luz. El rayo laser (luz azul) es filtrado por un agujero y un espejo dicroico; luego es enfocado mediante un lente objetivo sobre el espécimen y estimula la fluorescencia presente en el mismo (luz verde). La fluorescencia es recolectada por el objetivo y dirigida al espejo dicroico que la refleja y dirige hacia un detector. Un segundo filtro con agujero se coloca frente al detector y sólo deja pasar la luz proveniente del plano de enfoque (línea continua). La fluorescencia fuera de foco de las zonas que están por encima y por debajo del plano de enfoque (en líneas discontinuas) no pasa por el agujero y por lo tanto no formará parte de la imagen. Modificado de Olschewski F. (2000). Software in confocal microscopy (118).
La luz coherente del rayo laser es dirigida por espejos hacia el espécimen (el cual ha sido previamente tratado mediante marcadores fluorescentes) iluminándolo punto por punto y de manera seriada; la fluorescencia resultante es medida también punto por punto. Para obtener la información completa, el rayo laser debe ser desplazado por todo el espécimen (en los planos x, y, z) y este proceso es lo que se conoce como escaneo o barrido. Para reconstruir las imágenes a partir de los datos obtenidos, se emplean programas de computación adecuados (119).
6.7.3.-Configuración del microscopio confocal
Los microscopios
confocal modernos son instrumentos altamente sofisticados y sus elementos
principales son:
• La fuente de luz: Generalmente emplea una fuente
de luz muy poderosa (laser o lámpara de arco). Se pueden utilizar
sistemas de rayos laser multi-frecuencia (en el rango ultravioleta,
luz visible e infra-roja) adaptados a los tipos de marcadores fluorescentes
empleados para el contraste de los elementos celulares. Se han desarrollado
dos técnicas, la de escaneo con un solo rayo (laser) y el escaneo
con múltiples rayos. La primera es la más popular y emplea
un par de espejos controlados por computadora para escanear el espécimen.
La técnica multi-rayos utiliza una lámpara de arco y el
escaneo se realiza gracias a un disco rotatorio (disco de Nipkow) conformado
por micro-lentes y micro-agujeros. Esta última técnica
de iluminación disminuye el daño a los especímenes
e incrementa la detección (119).
• Sistema óptico: El sistema óptico de los microscopios está basado en los principios fundamentales que se mantienen inalterados, sin embargo están complementados con los avances en óptica moderna y la tecnología electrónica.
• Filtros de interferencia: Incluyen espejos dicromáticos o dicroicos, barreras con agujero de diámetro variable y diversos filtros de excitación (para seleccionar la longitud de onda de excitación del fluorocromo).
• Detectores: Son fotodetectores muy sensibles a la fluorescencia emitida. Para los microscopios con múltiples rayos generalmente se usan cámaras CCD (charge- coupled device).
•
Computadora: Configurada con los requisitos suficientes de
memoria y procesador, tarjetas de video de alta resolución, complementadas
con software de captura, análisis y procesamiento de imágenes,
así como también de impresoras de muy alta calidad (fig.
6-28).
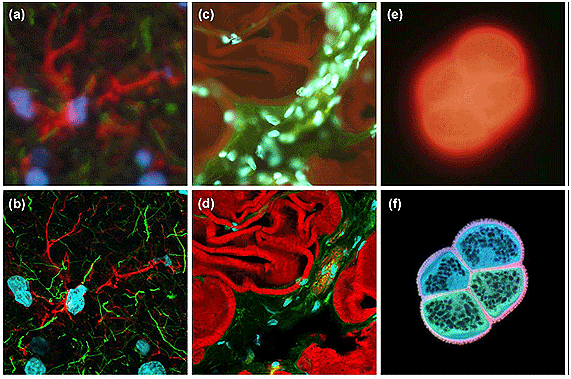
Figura 6-27.-Micrografías comparativas entre las técnicas de fluorescencia con iluminación convencional o de campo amplio (serie superior, a, c, e) y la iluminación en microscopía confocal (serie inferior b, d, f). Nótese en la serie superior la cantidad de señal (fluorescencia) que está fuera de foco y la contrastante nitidez de las imágenes de la serie inferior en las cuales sólo se obtiene exclusivamente la información del plano de enfoque. Las muestras de la izquierda (hipotálamo de ratón) y centro (músculo liso de rata) fueron marcadas con diversos fluorocromos (dobles y triples marcajes). Las imágenes de la derecha corresponden a un grano de polen de girasol el cual es autofluorescente. Tomado de Claxton N, Fellers T, Davidson M. (2008). Laser Scanning Confocal Microscopy (119).
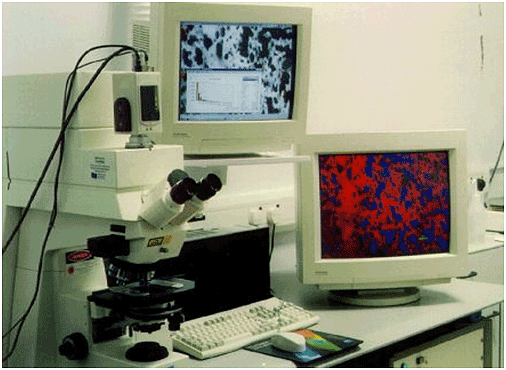
Figura 6-28.-Modelo de microscopio confocal. Tomado de Assessment of Food Ingredient Functionality using Laser Microscopy (120).
6.7.4.-Cortes ópticos y reconstrucción 3D
Con el microscopio confocal es posible obtener una imagen de un plano determinado del espécimen. Esta imagen se denomina sección o corte óptico fino y puede estar en el rango de 0.5-1.5 micrómetros. Se pueden obtener de una manera no invasiva a partir de especímenes fluorescentes cuyo espesor puede variar entre 50-100 micrómetros (121). Las imágenes se obtienen en una secuencia o serie, de manera manual o mediante un sistema automatizado. Las imágenes 2D (dos dimensiones) obtenidas a intervalos regulares siguiendo el eje óptico son combinadas y utilizadas para recrear una estructura en tres dimensiones (3D) mediante el empleo de software especializados (figs. 6-29, 6-30).
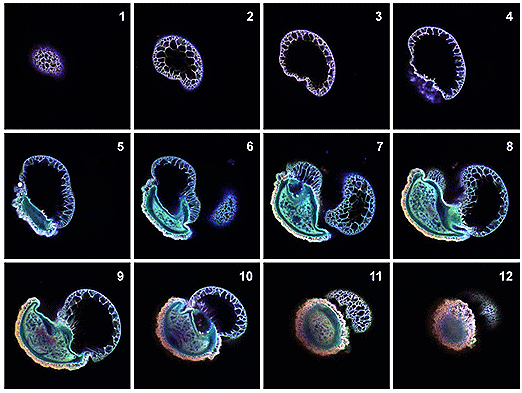
Figura 6-29.-Secciones ópticas seriadas de un grano de polen de Pinus contorta. Cada imagen fue obtenida a un intervalo de 3 micrómetros. Tomado de Claxton N, Fellers T, Davidson M. (2008). Laser Scanning Confocal Microscopia (119).
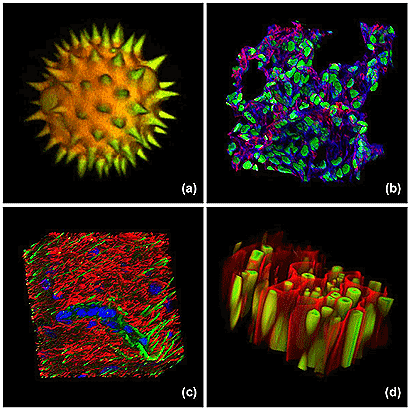
Figura 6-30.-Reconstrucciones tridimensionales a partir de cortes ópticos obtenidos con el microscopio confocal. (a) grano de polen, (b) muestra de hígado de ratón, (c) corte grueso de corteza cerebral de rata. Se emplearon varios marcadores fluorescentes. (d) auto fluorescencia de una porción de raíz de helecho. Las reconstrucciones fueron realizadas a partir de series de 30-45 cortes ópticos. Tomado de Claxton N, Fellers T, Davidson M. (2008). Laser Scanning Confocal Microscopy (119).
6.7.5.-Aplicaciones del microscopio confocal
En comparación
a los otros tipos de microscopios, el microscopio confocal proporciona
un método altamente sofisticado y mejorado para obtener imágenes.
En investigaciones en el campo de la biología celular y biomedicina
es muy útil para medir procesos dinámicos, realizar videos
para capturar secuencias en muy corto tiempo en células vivas
y otras aplicaciones (120, 122, 123, 124, 125, 126):
• Procesos celulares: Para medir actividades enzimáticas,
reacciones de oxidación, pH intracelular, fagocitosis, apoptosis,
comunicaciones intercelulares. Electrofisiología.
• Estudios de ADN y ARN.
• Morfología de organoides citoplasmáticos.
• Cirugía y otros métodos clínicos.
•
Otras aplicaciones en el campo de la física, la química
y en tecnología alimentaria.
6.8.-Otros tipos de microscopios